La thermodynamique
La thermodynamique, bête noire de la physique en classes préparatoires...
Loin de moi de vous faire un cours ici, il existe plein de sites qui feront ça mieux que moi. Je souhaite simplement rappeler quelques bases qui me serviront pour discuter plus tard d'éléments qui m'intriguent comme le démon de Maxwell et la théorie de l'information.
La thermodynamique est un truc marrant :
- La première fois que vous l’abordez, vous ne comprenez rien.
- La seconde fois que vous l’abordez, vous pensez tout comprendre, sauf un ou deux points.
- La troisième fois que vous l’abordez, vous savez que non, vous n’avez rien compris, mais ce coup-ci vous avez l’habitude et vous n’en avez plus rien à fiche.
A. Sommerfeld
Définition
La thermodynamique avec un nom pareil s'intéresse à la chaleur des corps et aux échanges de chaleur, ainsi que la transformation en travail.
Cette science est divisée en deux grandes sections :
- La thermodynamique phénoménologique, d'où l'on connait quelques principes et lois rappelés plus loin.
- La thermodynamique statistique, qui regarde ce qui se passe au niveau moléculaire, et où il faut aimer les probabilités ─et la statistique.
Dans la première, on aime les machines thermiques qui échangent travail et chaleur. Une machine à vapeur ou un réfrigérateur, par exemple un moteur Stirling basse température, une belle machine thermique pure et dure.
Dans la seconde, on va s'intéresser à la vitesse des molécules d'un gaz, et aux probabilités d'observer des configurations du genre "toutes les molécules se sont rassemblées dans un coin", ce qui permet d'en déduire des principes relatifs au désordre, autrement dit l'entropie. Et quand on couple cela avec la théorie de l'information, on se creuse vraiment la tête.
Loi des gaz parfaits
La loi des gaz parfaits est vraiment un élément de base en thermodynamique.
L'idée est de considérer un gaz comme une assemblée de molécules ─ce qui est le cas─ mais avec la particularité que lesdites molécules interagissent entre elles que d'une seule manière, en effectuant des chocs comme des boules de billard, des chocs dits élastiques car on ne perd aucune énergie, ce qui est vraiment le cas au premier ordre. Aucune autre interaction n'existe, pas de chimie en particulier.
L'hypothèse "boule de billard" permet de simplifier drastiquement l'étude d'un gaz, qui devient alors "parfait", enfin surtout parfait pour les physiciens car cela permet de déduire la "loi des gaz parfaits" qui relie la pression P, le volume V, la température T et le nombre de molécules (exprimé en mole) :

On remarquera que le type de molécule n'intervient pas, c'est uniquement le nombre qui compte. Il s'agit vraiment d'une loi générale, énoncée par Clapeyron en 1834.
La constante des gaz parfaits est le produit du nombre d'Avogadro et de la constante de Boltzmann :
La loi des gaz parfaits est généralement applicable lorsque la variation de la température est faible car il faut supposer les capacités thermiques constantes.
Il existe d'autres lois qui sont en fait des dérivées de la loi générale, il suffit de fixer deux paramètres parmi (P,V,T et la masse/nombre de particules). À connaitre surtout pour la culture.
Loi de Boyle-Mariotte

[1662] Loi de Boyle-Mariotte
Gaz à température constante
isotherme
PV = constante.
Loi de Charles

[1787] Loi de Charles
Gaz à pression constante
isobare
V/T = constante.
Loi de Gay-Lussac

[1802] Loi de Gay-Lussac
Gaz à volume constant
isochore
P/T = constante.
Loi d'Avogadro

[1811] Loi d'Avogadro
À volume, température et pression égaux, deux gaz parfaits différents contiennent le même nombre de molécules.
D'où le fameux nombre d'Avogadro :
- Origine des animations : Gas Lab
Loi de Laplace
Si la loi de Laplace a l'air de ressembler à la loi de Boyle-Mariotte à première vue puisqu'elle concerne un gaz parfait et le produit PV, elle est différente car elle s'applique à une réaction adiabatique, c'est-à-dire sans échange de chaleur, réversible et dont la capacité calorifique est constante :
γ étant le rapport de la capacité thermique isobare (à pression constante) et de la capacité thermique isochore (à volume constant).
Comme il s'agit d'un gaz parfait, les autres couples avec la température ont aussi une relation du même genre.
L'énergie
L'énergie est un terme général pour indiquer, à l'origine, une capacité à produire un mouvement, et maintenant nous savons tous de quoi il retourne, c'est ce qui permet d'effectuer des transformations, des calculs, etc...
Il existe pas mal de "sources d'énergie" et de "formes d'énergie", et il faut souvent revenir à la définition basique où une force intervient pour faire la part des choses. Par exemple la chaleur est considérée comme une source d'énergie, mais d'abord il s'agit d'une agitation "thermique" des molécules ou atomes, par exemple de vibrations ou encore liée à la vitesse, et de plus la chaleur n'a aucun intérêt si elle ne se présente pas sous au moins deux formes, une source chaude et une source froide, on verra ça plus loin.
L'énergie interne
En voici une liste, probablement incomplète, pour rappeler qu'il en existe beaucoup de formes :
- la masse des particules mc²
- l’énergie nucléaire de liaison entre particules (noyau atomique, électrons...)
- l’énergie cinétique des particules mv²
- les énergies de rotation, de vibration...
- l’énergie des interactions entre particules, magnétiques, électromagnétiques...
- l’énergie de liaison des molécules : l'énergie chimique
- l'énergie gravitationnelle
- ...
On notera le caractère additif de toutes ces énergies.
Ce qui est important est de bien noter les énergies inchangées dans un système, et celles qui sont modifiées.
L'énergie du vide
En voilà un titre intéressant, alors que nous allons aborder le premier principe de la thermodynamique ! C'est d'ailleurs pour ça que ce phénomène a droit à son paragraphe particulier.
L'énergie du vide est un terme un peu spécial pour désigner un phénomène quantique lié à l'apparition et disparition quasi-immédiate de particules virtuelles (en fait des particules-antiparticules), car il existe toujours des fluctuations irréductibles du champ électromagnétique. D'ailleurs le vide quantique désigne l'état fondamental du champ électromagnétique en l'absence de toute source.
Les niveaux d'un oscillateur harmonique sont quantifiés de manière régulière et donnés par :
m est le nombre de photons à la pulsation ω en théorie quantique du champ. Avec m=0 ─pas de photon─ on a une énergie fondamentale non nulle ½ ħ ω, reflet au principe d'incertitude d'Heisenberg. C'est l'énergie du vide.
Je vous encourage à consulter ma page sur l'effet Casimir et l'énergie du vide.
La question à deux balles est alors : peut-on extraire de l'énergie à partir de l'énergie du vide ? Si la réponse est oui, alors notre crise énergétique concernant les énergies fossiles est résolue...
Eh bien non, on n'arrive pas à extraire de l'énergie à partir du vide encore heureux ! D'aucun pourrait penser que c'est faisable quand on considère la force déployée dans l'effet Casimir, mais non, car il faut un déplacement, puis revenir. Pour s'en convaincre, pensez aux aimants : on a une force d'attraction, mais on n'arrive pas à extraire de l'énergie uniquement à partir d'aimants.
Relativité
Pour rappel, la quantité d'énergie dépend de l'observateur, surtout s'il se déplace vite, genre proche de la vitesse de la lumière, et forcément puisque vu d'un référentiel en mouvement, l'objet observé aura une certaine vitesse et donc une certaine énergie cinétique, multipliée par le facteur de Lorentz (qui vaut 1 à faible vitesse).
Pour commencer, on évitera les situations relativistes, histoire d'éviter les maux de têtes.
Approche statistique
Lorsque l'on considère les molécules d'un gaz, elles sont agitées (c'est le mouvement brownien) possèdent leur propre énergie cinétique, s'entrechoquent en échangeant de l'énergie cinétique, mais tapent également les parois du contenant.

Ceci est l'origine fondamentale de :
- la température : caractérisées par la vitesse quadratique moyenne
- la pression : les chocs statistiques des molécules sur une paroi
N'existant pas de direction privilégiée par symétrie (c'est isotrope), les vitesses moyennes sur chaque axe sont nulles, il n'y a pas de mouvement d'ensemble (il n'y a pas de vent si vous préférez).
Température cinétique
Une particule de masse m ayant une vitesse v présente une énergie cinétique :
La loi de distribution des vitesses de Maxwell (théorie cinétique des gaz) relie la vitesse quadratique moyenne ∥v²∥ de N particules et la température via la constante de Boltzmann :
Il s'agit de ce qu'on appelle l'énergie interne, traditionnellement notée U.
Attention, la vitesse la plus probable n'est pas la vitesse quadratique moyenne :
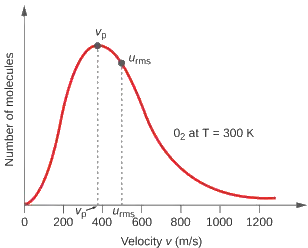
u rms, vitesse quadratique moyenne, proche de 500 m/s
On se souviendra qu'un vent de 100 km/h fait 27 m/s, ce qui est assez faible devant la vitesse des molécules de l'air.
Pression cinétique
La théorie cinétique des gaz parfaits nous donne non seulement la température, mais également la pression sur une paroi :
Avec le volume V et l'énergie interne U vue précédemment, soit :
On voit bien que ça dépend du nombre de particules dans un volume donné, et de leur vitesse (quadratique moyenne). Et que la loi des gaz parfaits n'est pas loin.
Il s'agissait d'un gaz parfait. On complique l'analyse en ajoutant (petit à petit) des effets non pris en compte, et ce faisant on se rapproche du réel. Je n'irai pas plus loin ici, vous trouverez sur le web des cours sur la théorie cinétique des gaz si vous voulez creuser.
Rendement d'une machine thermique
Une machine thermique permet de transférer de l'énergie sous forme d'un travail, que ce soit fournir un travail ou le recevoir, grâce à un transfert de chaleur entre une source chaude et une source froide.

De la chaleur provient de la source de chaleur chaude, une partie est transformée en travail dans le moteur, et un reste de chaleur va vers la source froide "qui l'attire".
- Le transfert de chaleur se fait naturellement du chaud vers le froid, et dans ce cas le moteur fournit un travail.
- Si on fournit de l'énergie au moteur sous forme d'un travail, alors on peut extraire de la chaleur depuis la source froide et la forcer à aller vers la source chaude, c'est une machine frigorifique ou pompe à chaleur
Cycle de Carnot
Le cycle de Carnot traduit le fonctionnement d'un moteur thermique :
Quatre transformations se produisent, certaines avec échange de chaleur, et d'autres sans échange de chaleur = adiabatique :
- AB : détente isotherme
- BC : détente adiabatique
- CD : compression isotherme
- DA : compression adiabatique
La surface du cycle est le travail récupéré par le moteur.
Rendement de Carnot
Carnot a montré que le rendement d'une telle machine thermique ne pouvait pas être supérieur à une certaine valeur ne dépendant que des températures de la source froide et chaude :

On voit facilement que l'on a intérêt à avoir une température chaude aussi haute que possible, et froide aussi froide que possible, et la différence compte pour beaucoup.
Par exemple il existe des petits moteurs Stirling dit "faible différence de température", de l'ordre de quelques degrés, avec un rendement qui sera forcément très faible, inférieur à 0,33% pour 1 degré d'écart à température ambiante (300 K). Ce qui n'est pas favorable, d'où la difficulté pour réaliser ces moteurs et éliminer au maximum tous les frottements...
Le rendement maximal d'une machine frigorifique est du même tonneau.
L'entropie
L'entropie est une grandeur qui caractérise le désordre et (spoiler) on verra plus loin l'irréversibilité de certaines transformations ou réactions.
On relie l'entropie S à la chaleur Q et la température T par la relation :
Et il existe des raffinements si la transformation est réversible ou non.
Formule de Boltzmann
En thermodynamique statistique, on relie également l'entropie au nombre d'états microscopiques Ω et à la constante de Boltzmann kB :
Si vous laissez un ado seul à gérer sa chambre, et bien au
bout d'un moment, c'est le bordel, un désordre infâme
(sauf si vous avez un ado bien élevé).
On constate que naturellement, si on laisse faire "la nature",
le désordre a tendance à s'installer.
Si vous voulez ranger, il faut injecter de l'énergie,
généralement les parents...
C'est la même chose avec un paquet de molécules d'oxygène
que vous avez dans un flacon, et un paquet de molécules d'azote,
par exemple le même nombre, dans un second flacon.
Si vous reliez les deux flacons, et bien,
sans rien faire la magie est là les molécules vont se mélanger,
et vous serez incapable de récupérer d'un côté l'oxygène
et de l'autre l'azote sans dépenser de l'énergie.
Energie et enthalpie, libre ou pas
Abordons les choses qui sont absconses quand on attaque la thermodynamique, que je n'ai pas pu blairer lors de l'enseignement en classes préparatoires...
L'enthalpie est utile pour les réactions chimiques car il se produit un échange thermique avec l'extérieur, qui dépend des conditions expérimentales :
- Dans une transformation isochore (=à volume constant) la chaleur échangée égale la variation d'énergie interne : QV = ΔU
- À pression constante, isobare (souvent à l'air libre), la chaleur égale la variation d'enthalpie : QP = ΔH
On voit donc la proximité de l'enthalpie avec l'énergie, c'est une distinction commode pour les chimistes.
Energie libre
L'énergie, passe encore, c'est une chose assez connue, même sans connaitre la thermodynamique. L'enthalpie, pourquoi pas ? Mais pourquoi énergie et enthalpie "libre" ? C'était du temps de la révolution française ?
L'énergie libre F (énergie de Helmholtz) permet d'obtenir le travail obtenu par un système thermodynamique fermé, à température constante, au cours d'une transformation réversible.
Elle est définie par :
Oui, c'est bien l'entropie S.
Les propriétés de l'énergie libre :
- À volume et température constants, une transformation réelle ne peut s’effectuer qu’avec une diminution de l’énergie libre du système.
- À température constante, le travail d'une transformation réversible égale la variation d'énergie libre.
Enthalpie libre
C'est le même cinéma que l'énergie libre, mais à pression et température constantes. L'enthalpie libre G (énergie de Gibbs) est définie par :
Avec des propriétés similaires :
- À pression et température constantes, l'enthalpie libre ne peut que décroitre.
- Le signe de l'enthalpie libre de réaction indique le sens dans lequel se déplace l'équilibre chimique. Au minimum, l'équilibre chimique est atteint.
On vit très bien sans connaitre l'énergie libre et l'enthalpie libre, sauf si on est chimiste.
Principes
Les fameux principes de la thermodynamique.
Rappelons-les, en particulier le plus fameux qui est le second principe.
Avant le premier principe, on se souviendra de l'équilibre thermique, en particulier entre deux systèmes, surtout si l'un deux est un thermomètre ─cela pourrait être utile. Une sorte de principe encore plus fondamental, cette histoire d'équilibre thermique. Et c'est une relation symétrique et transitive, dirait un matheux.
Premier principe
Conservation de l'énergie
Rien ne se perd, rien ne se crée, tout se transforme. (Lavoisier)
La conservation de l'énergie est un principe vraiment fondamental, qui implique que de l'énergie ne peut apparaitre à partir de rien (c'est là qu'il faut rappeler le coup de l'énergie du vide).
On dit la même chose en écrivant :
autrement dit, la variation d'énergie interne U est la somme de la chaleur reçue/envoyée et du travail reçu/envoyé. Tout ça, c'est du transfert d'énergie.
Second principe
L'entropie d'un système isolé augmente ou reste constante.
La chaleur ne passe pas spontanément d’un corps froid sur un corps chaud. (Enoncé de Clausius)
Un système en contact avec une seule source de chaleur ne peut, au cours d’un cycle, que recevoir du travail et fournir de la chaleur. (Enoncé de Thomson)
Surtout si on n'a pas le droit d'ouvrir le bocal.
Avec une seule source de chaleur, on ne peut réaliser une machine thermique motrice
Il existe également l'entropie de Shannon, qui s'intéresse à la théorie de l'information. On verra ça dans un autre chapitre, relatif au démon de Maxwell.
Troisième principe
Aussi appelé principe de Nernst.
L'entropie S d'un système thermodynamique en équilibre interne se rapproche d'une constante universelle S0 quand la température absolue T tend vers zéro.
Voilà pour le résumé des basiques en thermodynamique. C'est une science plus développée qu'il n'y parait, souvent d'accès difficile, vous trouverez des leçons et des livres assez facilement sur le sujet, par exemple les articles du Bulletin de l'union des physiciens.
Tout ceci me permet d'aborder des sujets plus particuliers sans avoir à revenir sur ces fondamentaux. J'ai un peu de mal avec la théorie de l'information, et en particulier le coup du démon de Maxwell...
Pour commencer pour finir ? allons directement à la fin du monde car si l'entropie ne peut qu'augmenter, que va-t-il se passer pour l'univers ?