Chaleur et électrons
Les cellules thermo-électrochimique ne sont que la version liquide des thermocouples. Ou un thermocouple est la version à l'état solide d'une cellule thermo-électrochimique.
Définition
Les thermocouples transforment un gradient de température, autrement dit une variation de température, le long de matériaux, afin de générer une différence de potentiel et un courant. Par exemple, on utilise des semi-conducteurs de type n et p pour faire des générateurs thermoélectriques, et l'ordre de grandeur du coefficient Seebeck est de quelques μV/K.
Une cellule thermo-électrochimique (thermocell en anglais) utilise l'oxydo-réduction dans un électrolyte pour générer des différences de potentiel plus importantes, de l'ordre de quelques mV/K. A la différence d'une pile, une thermocellule possède deux électrodes identiques, formant un couple redox avec l'électrolyte, et une connexion externe. Mais on retrouve parfois les termes cellule galvanique.
Sous l'action d'un gradient thermique (une différence de température), on aura une oxydation à l'anode et une réduction à la cathode. L'espèce réduite sera transportée vers l'anode par un mécanisme de diffusion, convection ou migration dans l'électrolyte, créant une réaction continue et un courant.
L'idée est d'avoir un système produisant de l'électricité en permanence, sans consommation de matériaux et sans produire d'émission : la différence de température est transformée en électricité, comme dans les générateurs thermoélectriques à l'état solide (un Peltier quoi, mais cette fois il est chimique).
Exemples
Voici quelques exemples pour illustration.
Une thermocellule à KBr

- Sur l'électrode froide, la cathode, le gaz Br2 récupère des électrons dans l'électrode en graphite et se dissocie en ions Br-, lequel graphite joue un rôle-clé. KBr pour bromure de potassium.
- Les ions Br- diffuse par le canal vers l'électrode chaude, l'anode, où ils se transforment en gaz Br2, relâchant 2 électrons.
- Le brome revient vers la cathode par le canal supérieur.
- Les électrons circulent de l'anode à la cathode, c'est le courant électrique.
Ce genre de système est plutôt instable, avec largage de produits indésirables.
Cuivre
Dans une cellule à cuivre, les électrodes sont solubles :
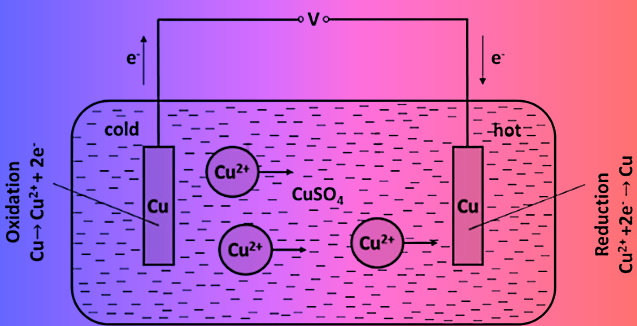
La dissolution du cuivre pose évidemment un problème : il va falloir périodiquement échanger le chaud et le froid pour inverser la réaction. C'est pénible.
Ferrocyanure
On préfèrera des électrodes inertes, comme dans le système à ferri/ferrocyanure :

Les ions ferri et ferro circulent en permanence entre les deux électrodes, cela parait magique de ce point de vue.
État d'avancement
Il existe pas mal de variantes, d'un intérêt relatif à décrire ici car je voulais juste indiquer l'existence de ce type de thermogénérateur.
L'idée de base est de récupérer de l'énergie électrique à partir de faibles gradients thermiques, mais bon les systèmes à état solide sont nettement plus pratiques, comme on peut s'en douter.
Ceci dit, les performances sont tentantes [2022] : un coefficient Seebeck "géant" de -37 mV/K, une figure de mérite de 3.74 et une efficacité de 11%.
Un article gratuit (ce n'est pas courant) :
Avec ces effets, comme on peut le deviner, on réalise des thermomètres, des pompes à chaleur pour faire des réfrigérateurs, on génère de l'énergie électrique à partir de sources de chaleur, par exemple radioactives pour les missions spatiales, et bien d'autres applications à découvrir page suivante.