Spin des électrons

AVERTISSEMENT : tout ce que je raconte ici n'est qu'un vernis superficiel, souvent simplifié afin de commencer à y comprendre quelque chose, même si la collection d'effets parait déjà bien longue et compliquée. La dure réalité est bien plus complexe, les chercheurs ne sont pas toujours d'accord entre eux sur les interprétations de ce qu'ils testent, alors restez humbles. Mais bon, cela devrait déjà suffire à vous aider à paraitre intelligent en société...
Le spin est une propriété quantique. Voyons voir de quoi il retourne.
En mécanique classique, outre le déplacement des objets (quantité de mouvement), on considère aussi leur rotation sur eux-mêmes (moment cinétique propre), qui est une grandeur vectorielle, un vecteur dont la direction est celle de l'axe de rotation.
En mécanique quantique, on a aussi une espèce de moment cinétique propre ou moment angulaire intrinsèque, qui a été appelé spin, mais bon, ce n'est qu'une représentation mentale, les quantons ne tournent pas vraiment sur eux-mêmes.
Une originalité cependant : les valeurs que peut prendre le spin sont quantifiées, et la valeur fondamentale est la constante de Planck réduite (divisée par 2 π) dite "hache-barre".
- Le spin de l'électron vaut ½, en fait ħ/2. Proton et neutron idem.
- Le photon a un spin 1.
- Les mésons p un spin 0.
On a classé les particules en deux catégories :
- Les fermions de spin demi-entier : électron, proton, neutron, neutrino, quark, ... Ils suivent le principe d'exclusion de Pauli, il ne peut pas y avoir deux particules identiques.
- Les bosons de spin entier : photon, gluon, ... Ils suivent la statistique de Bose-Einstein, et ont un comportement de groupe (par ex. condensats de Bose-Einstein).
Mais ce n'est pas tout : les orientations du spin s sont quantifiées, et il en existe 2s + 1 :
- Le spin de l'électron, ½, n'a que 2 orientations possibles : -½ et +½
- Le spin du photon, 1, n'a que 3 possibilités : -1, 0 et +1 (qu'on peut se représenter comme étant une polarisation circulaire gauche, droite ou plane).
Les particules composées ont un spin qui est fonction de leurs particules élémentaires, mais c'est une autre histoire, on va s'arrêter là car on s'intéresse à l'électron ici.
Expérience de Stern et Gerlach
J'en avais déjà parlé un peu dans ma section de mécanique quantique à propos de la superposition.
Le petit film suivant présente bien ce la découverte de ce phénomène de spin sur l'électron (inutile que je m'enquiquine à refaire ce qui est bien) :
On retiendra qu'il existe deux catégories d'électron : ceux qui ont le spin vers le haut, et les autres vers le bas. Ce qui rend les choses "pas trop compliquées" vu qu'il n'y a que deux états.
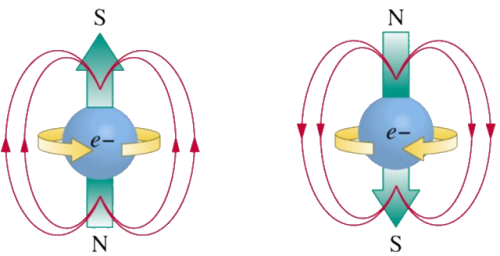
Comme il n'existe que deux états, -½ et +½, on les note souvent up et down, avec une flèche : ↑ et ↓.
La spintronique
La spintronique, c'est simplement de l'électronique où on fait intervenir des courants de spin. Pour l'instant, il s'agit surtout de têtes de lecture de disques durs et de mémoires magnétiques dites MRAM, on verra ça vers la fin.
Electron dans un atome
Dans un atome, chaque électron peut être caractérisé par quatre nombres quantiques :
- n : le nombre quantique principal. Il correspond à la couche dans laquelle se situe l’électron et peut prendre des valeurs entières strictement positives (1,2,3,...). Il correspond à un niveau d’énergie principal de l’électron. On lui associe parfois une lettre (K,L,M,N,O,P,...). On peut le voir comme donnant une indication sur la distance moyenne de l’électron avec le noyau.
- l : le nombre quantique secondaire. Il s’agit d’un nombre entier tel que 0 ≤ l < n. Il désigne la sous-couche et correspond au moment angulaire orbital de l’électron. On le retrouve également souvent associé à une lettre (s, p, d, f, g,...). Il donne une information sur la forme de l’orbitale considérée.
- ml : le nombre quantique magnétique. C’est un entier tel que −l ≤ ml ≤ l. Il correspond à l’orientation de l’orbitale.
- ms : le nombre quantique magnétique de spin. Il peut être vu comme étant la projection du moment angulaire intrinsèque de l’électron sur l’axe de quantification.
Le principe de Pauli impose qu’au sein d’un même atome, deux électrons ne puissent avoir les mêmes quatre nombres quantiques. Cela revient à dire que chacune des orbitales de l’atome, décrites par les trois premiers nombres quantiques, ne peut contenir que deux électrons puisqu'il ne peut avoir que deux valeurs : +½ et −½.
On peut faire des courants de spin, on a de l'effet Hall relatif au spin, et aussi de l'effet Seebeck et plein d'autres choses, la charge des électrons n'a pas de privilèges particuliers... La spintronique s'intéresse à la manipulation du spin des électrons, à l'instar de l'électronique.